اوربیتال هیبریدی
طبق تعریف ، تمام اوربیتالهایی که در یک مولکول در تشکیل پیوند و نهایتا تشکیل مولکول شرکت میکنند، دارای انرژی یکسانی میباشند. به این علت که اوربیتالهای اتمهای متفاوت باهم همپوشانی میکنند و مخلوط میشوند و به اصطلاح هیبرید گردیده و باعث ایجاد "اوربیتالهای هیبریدی" میشوند.
دید کلی
طبق قانون ، عناصر با تشکیل پیوند با یکدیگر با رسیدن به آرایش هشت تایی گاز نجیب بعد از خود به پایداری میرسند. اما ترکیباتی مهم وجود دارند که این قانون را مکررا نقض میکنند. در این ترکیبات اتمهایی وجود دارند که تعداد الکترونهای لایه ظرفیت آنها بیشتر یا کمتر از هشت الکترون است.
برای توجیه ارتباط بین آرایش الکترونی حالت اصلی یک اتم و خواص ساختمانی مشاهده شده ترکیبی که این اتم تشکیل میدهد، دانشمندان مفهوم هیبرید شدن را مطرح کردهاند. هیبرید شدن یک مفهوم نظری است که نواقص ساختمان لوئیس یعنی فقدان ارتباط بین ساختمان لوئیس و ساختار هندسی مولکول را برطرف میکند.
بررسی اوربیتالهای مولکول متان با استفاده از نظریه VSEPR
به استثنای مواردی بسیار معدود ، پیش بینیهایی که بر اساس نظریه دافعه جفت الکترونی به عمل آمده است، صحیح بوده و با واقعیت انطباق دارند. مثلا نظریه مزبور پیش بینی میکند که مولکول متان CH4 ، چهار وجهی است، زیرا اتم مرکزی C در پوسته والانس خود چهار جفت الکترون پیوندی دارد.
شواهد تجربی بسیار ، درستی این پیش بینی را تائید کرده است. در مولکول متان چهار پیوند C-H از لحاظ طول پیوند و استحکام یکسانند و تمام زوایای پیوندی H-C-H زوایای چهار وجهی '28 ،˚109 است.
توجیه تشکیل پیوند چهار وجهی متان
طبق نظریه پیوند والانس ، هر پیوند کووالانسی ، متشکل از یک جفت الکترون (با اسپینهای مخالف) است که هر دو اتم در آن شرکت دارند. میتوان تصور کرد پیوند کووالانسی وقتی بوجود میآید که یک اوربیتال (حاوی یک الکترون جفت نشده) از یک اتم با اوربیتالی (حاوی یک الکترون جفت نشده) از اتم دیگر همپوشانی میکند. اگر قرار باشد در این چهار چوب فکر کنیم، چگونه میتوانیم تشکیل پیوند چهار وجهی متان توجه کنیم؟
آرایش الکترونی حالت پایه کربناست که نشاندهنده تنها دو الکترون جفت نشده است. شاید این نوع آرایش ، این تصور غلط را ایجاد کند که اتم C ، با اتمهای H تنها دو پیوند کووالانسی بوجود میآورد، ولی اگر یکی از الکترونهای 2s به اوربیتال خالی 2p ، ارتقا داده شود، اتم برانگیخته کربن (
) چهار الکترون جفت نشده لازم برای تشکیل چهار پیوند C-H را تامین خواهد کرد. چگونه میتوان بر پایه این حالت برانگیخته اتم کربن تشکیل پیوند را در CH4 توجیه کرد؟
فرض میکنیم هر اوربیتال پیوندی مولکول ، نتیجه همپوشانی یک اوربیتال اتمی C و یک اوربیتال 1s اتم H است. چون چهار اوربیتال پیوندی چهار وجهی متان هم ارزند، پس چهار اوربیتال اتمی کربن که آنها را بوجود آوردهاند، نیز باید دقیقا یکسان باشند و محورشان در امتدادی باشد که با یکدیگر زوایای '28،˚109 تشکیل دهد، اما اوربیتال 2s و اوربیتالهای 2p اتم کربن نه یکسان هستند و نه در امتداد گفته شده ، جهت گیری کردهاند. بنابراین نمیتوانیم نحوه تشکیل پیوند را به این صورت ساده تجسم کنیم.
فرآیند هیبریداسیون
در مولکولهایی مانند BeCL2 که اتم مرکزی در حالت اصلی ، اوربیتال نیمه پر (الکترون فرد) برای ایجاد پیوند با اتم دیگر در اختیار ندارد، برای تشکیل پیوند باید ابتدا به صورت برانگیخته در آید. به عنوان مثال در حالت برانگیخته اتم Be یکی از الکترونهای اوربیتال 2s به تراز بالاتر یعنی 2p انتقال مییابد. بنابراین دو الکترون جفت نشدهای برای تشکیل دو پیوند در اختیار Be قرار میگیرد. طبق بررسیهای طیف سنجی هر دو پیونداز نظر طول ، استحکام و انرژی ، همارز میباشند.
بنابراین بریلیم در حالت برانگیخته با کلر پیوند برقرار نکرده است، زیرا در این حالت یکی از پیوندها بین اوربیتال 2p کلر با اوربیتال 2s بریلیم و دیگری بین اوربیتال 2p اتم دیگر و اوربیتال 2p بریلیم ایجاد میشود و در این صورت پیوندها با هم ، همارز نخواهند بود. ساختمان این مولکول را میتوان با این فرض توضیح داد که یک اوربیتال 2s و یک اوربیتال 2p اتم بریلیم با یکدیگر در آمیخته و به صورت دو اوربیتال هیبریدی درمیآیند که با یکدیگر هم ارز هستند.
سپس اوربیتال 2p هر اتم کلر با هر کدام از این اوربیتالهای هیبریدی همپوشانی کرده و مولکول کلرید بریلیم
ایجاد میکنند. انواع اوربیتال هیبریدی
اوربیتال هیبریدی sp
یک مجموعه اوربیتالهای هیبریدی sp (ناشی از یک اوربیتال s و یک اوربیتال p اتم مرکزی) را میتوان برای توصیف نحوه تشکیل پیوند مولکولهای خطی که اتم مرکزیشان دو جفت الکترون پیوندی دارد (مثل HgCL2 یا BeCL2) بکار برد. تعداد اوربیتالهای هیبریدی در هر مورد برابر تعداد اوربیتالهای اتمی است که در ترکیب ریاضی برای بدست آوردن آن بکار گرفته شده است.
اوربیتال هیبریدی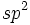
درگیر شدن تمام اوربیتالهای پوسته والانس اتم مرکزی یک مولکول ، در تشکیل اوربیتالهای هیبریدی ضرورت ندارد. تنها آن تعداد از اوربیتالهای مزبور برای تشکیل اوربیتالهای هیبریدی مورد استفاده قرار میگیرد که تعداد پیوند لازم و نیز شکل هندسی مولکول را تامین کند. برای مثال توابع موجی سه اوربیتال هیبرید SP2 را میتوان از ترکیب ریاضی توابع موجی یک اوربیتال s و دو اوربیتال p بدست آورد. یکی از سه اوربیتال p ، در این عمل شرکت نمیکند.
محورهای سه اوربیتال هیبریدی SP2 در یک صفحه قرار دارند و به گونهای به سه گوشه جهت گرفتهاند که زوایای بین آنها ˚120 باشد. این مجموعه برای توصیف حالت پیوندی مولکولهای مثلثی مسطح که اتم مرکزی آنها سه جفت الکترون غیر پیوندی دارد (مانند BF3) بکار برده میشود.
اوربیتال هیبریدی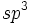
هیبریداسیون SP3 یک نوع مهم و متداول میباشد. این اوربیتالها از هیبرید شدن یک اوربیتال s و 3 اوربیتال p تشکیل میشوند. هر 4 اوربیتال هیبریدی همارز بوده هر کدام ¼ خاصیت s و ¾ خصلت p دارند. اوربیتالهای هیبریدی SP3 به سوی گوشههای یک چهار وجهی منتظم جهت گیری میکنند. شکل مولکول حاصل از اتم مرکزی دارای اوربیتال SP3 ، چهاروجهی بوده و تمام زوایا برابر با ´28 و ˚109 است.
- اوربیتال هیبریدی SP3 با یک جفت الکترون غیر پیوندی: در مولکولهایی مانند NH3 میتوان تصور کرد که اتم نیتروژن از اوربیتالهای هیبریدی SP3 استفاده کرده است، که یکی از آنها توسط یک جفت الکترون غیر مشترک اشغال شده است. اتمهای مولکول NH3 یک هرم مثلثی تشکیل میدهند. ولی آرایش 4 اوربیتال N تقریبا به صورت یک 4 وجهی است و زاویه پیوند برابر با ˚ 107 و ´3 میباشد.
- اوربیتال هیبریدی SP3 با دو جفت الکترون غیر پیوندی: اتم اکسیژن هم در مولکول H2O از اوربیتالهای SP3 استفاده میکند که در آن دو اوربیتال هیبریدی توسط دو جفت الکترون غیر مشترک اشغال شدهاند. زوایای اتم H2O و ˚104.5 میباشد که این زاویه به ˚109 نزدیکتر است تا به ˚90 ، که در صورت بکار رفتن اوربیتال خالص p ، انتظار میرفت.
اوربیتال هیبریدی دارای اوربیتال d
- اوربیتالهای
: این اوربیتالها از هیبرید شدن 2 اوربیتال d و یک اوربیتال s و 3 اوربیتال p بوجود میآیند. 6 اوربیتال هیبریدی ایجاد شده 6/1 خصلت s و 6/3 خصلت p ، و 6/2 خصلت d دارند. هر 6 اوربیتال با یکدیگر همارز بوده و به سوی گوشههای یک هشت وجهی منتظم جهتگیری دارند. یک نوع از اینها با یک جفت الکترون غیر پیوندی (این اوربیتال دارای شکل هرم ، با قاعده مربع) بوده و نوع دیگرش با دو جفت الکترون غیر پیوندی (این اوربیتال دارای شکل مربع مسطح) میباشد.
- اوربیتالهای هیبریدی
: اوربیتال هیبریدی
از یک اوربیتال d و یک اوربیتال s و 3 اوربیتال p حاصل میشود. اوربیتال اتمی
، در تشکیل این اوربیتال هیبریدی دخالتی ندارد. پنج اوربیتال حاصل با یکدیگر همارز نیستند. این اوربیتالها در گوشههای یک دو هرمی مثلثی جای میگیرند. زاویه بین پیوندهایی که در قاعده قرار گرفتهاند ˚120 و پیوندهای خارج از قاعده ˚90 و زاویهای که دو راس هرم را به هم وصل میکند ˚180 میباشد.
تشریح مولکولها با استفاده از مفهوم اوربیتالهای هیبریدی
مفهوم اوربیتالهای هیبریدی را نیز میتوان برای تشریح تقریبی مولکولهایی که دارای یک یا چند جفت الکترون ناپیوندی در پوسته والانس اتم مرکزیشان هستند، بکاربرد. مثلا در مولکول NH3 ، میتوان تصور کرد که اتم مرکزی N چهار اوربیتال SP3 را مورد استفاده قرار میدهد. یکی از اوربیتالهای SP3 ، جفت الکترون ناپیوندی را در خود جای میدهد و سه اوربیتال دیگر برای تشکیل پیوند با اتمهای H بکار گرفته میشوند.
زاویه پیوندی H-N-H در مولکول NH3 (برابر ˚107) به زاویه چهار وجهی اوربیتالهای هیبریدی SP3 (برابر '27 ،˚109) نزدیک است و تفاوت این دو را میتوان به تاثیر دافعه جفت الکترون ناپیوندی نسبت داد.
نکات مهم در هیبریداسیون اوربیتالها
- محاسبات نشان میدهد که استفاده از اوربیتالهای هیبریدی به تشکیل پیوندهای قویتر منجر میشود.
- انرژی لازم برای ایجاد حالت برانگیخته و همچنین انرژی لازم برای هیبرید شدن ، بیشتر از انرژی آزاد شده به هنگام تشکیل دو پیوند نسبتا قوی کوالانسی است.
- اوربیتالهایی که در آنها دو نوع معینی از هیبریداسیون بکار رفته است، باید از لحاظ انرژی نسبتا به هم نزدیک باشند.
- اوربیتالهایی که معمولا در تشکیل پیوند بکار میروند اوربیتالهای d , p , s لایه خارجی و در برخی موارد اوربیتال d لایه ماقبل لایه خارجی هستند. به استثنای این اوربیتالهای d داخلی ، الکترونهای اوربیتالهای داخلی معمولا آن قدر به هسته وابسته هستند که نمیتوانند در تشکیل پیوند شرکت کنند.
http://www.roshd.ir/
دوست عزیز، به سایت علمی نخبگان جوان خوش آمدید
مشاهده این پیام به این معنی است که شما در سایت عضو نیستید، لطفا در صورت تمایل جهت عضویت در سایت علمی نخبگان جوان اینجا کلیک کنید.
توجه داشته باشید، در صورتی که عضو سایت نباشید نمی توانید از تمامی امکانات و خدمات سایت استفاده کنید.







 پاسخ با نقل قول
پاسخ با نقل قول


علاقه مندی ها (Bookmarks)